PRUEBA DE TAMIZAJE: PRUEBAS DE COAGULACIÓN
Sin anticoagulante:
·
Tiempo de coagulación
·
Tiempo de sangría
·
Retracción del coágulo
·
Prueba del torniquete
Con anticoagulante (citrato
de sodio 3,8%)
·
Tiempo de protrombina
·
Tiempo parcial de tromboplastina
·
Tiempo de trombina
·
Fibrinógeno
·
Factores de la coagulación
·
Recuento de plaquetas
|
Prueba
|
Valores normales
|
|
Recuento de plaquetas
|
150 000 – 450000/ml
|
|
Tiempo de sangrado (Duke)
|
3 – 7 minutos
|
|
Tiempo de coagulación (Lee-White)
|
5 – 10 minutos
|
|
Tiempo de protrombina
|
10 – 14 segundos >60%
|
|
Razón Internacional normalizada
|
O,8 – 1,2
|
|
Tiempo de tromboplastina parcial activado
|
25 – 45 segundos
|
|
Tiempo de trombina
|
9 – 35 segundos
|
|
Tiempo de trombina
|
9 – 35 segundos
|
|
Fibrinógeno
|
200 – 400 mg/dL
|
|
Productos de degradación de fibrina
|
0,11 (<10 mg/mL)
|
|
Dímero D
|
<500 ng/mL
|
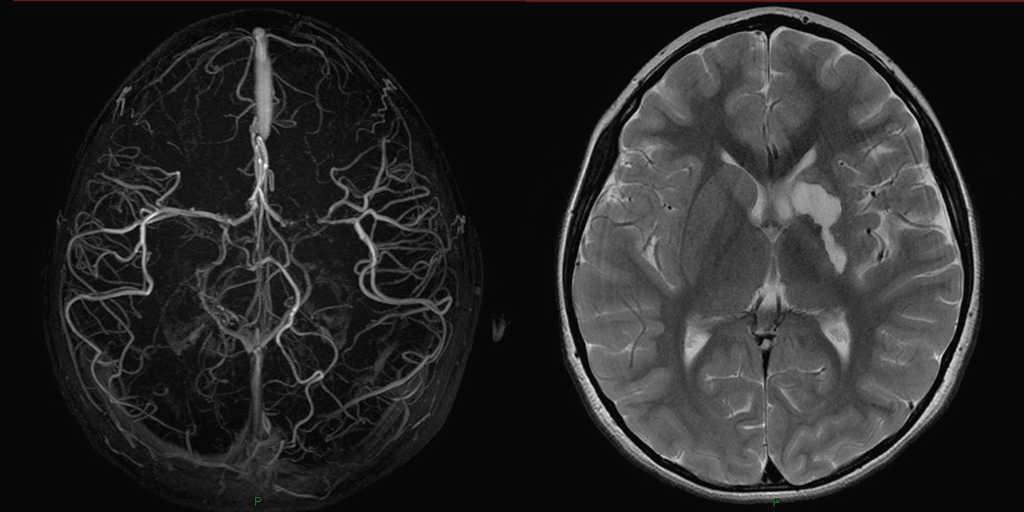
PRUEBA CONFIRMATORIA: ANGIORESONANCIA DEL CRÁNEO
La angioresonancia es un examen
en el que se utiliza la resonancia magnética con el fin de obtener imágenes
detalladas de los vasos sanguíneos, en este caso, del cráneo.
Con este estudio se pueden
diagnosticar aneurismas en la aorta, enfermedad arterioesclerótica de las
arterias carótidas en el cuello, enfermedades en los vasos sanguíneos del
cerebro como pequeños aneurismas o malformaciones arteriovenosas, teniendo en
cuenta que los vasos sanguíneos del cerebro llegan a tener diámetros menores al
de un cabello humano, haciendo de este un estudio muy sensible a la hora de
saber qué sucede con la circulación sanguínea del cerebro.
Durante el examen se puede usar,
o no, medio de contraste que se inyecta por una línea intravenosa, y que, junto
al mismo resonador, son responsables de la sensibilidad y especificidad del
estudio.
Referencias bibliográficas:


